A epilepsia é uma doença neurológica crônica, caracterizada pela predisposição do cérebro em gerar crises epilépticas de forma espontânea e recorrente. Afetando aproximadamente 1,5% da população global, essa condição pode ocorrer em indivíduos de qualquer idade, gênero, etnia ou classe social, acarretando consequências neurobiológicas, cognitivas e psicossociais.
Epilepsia genética
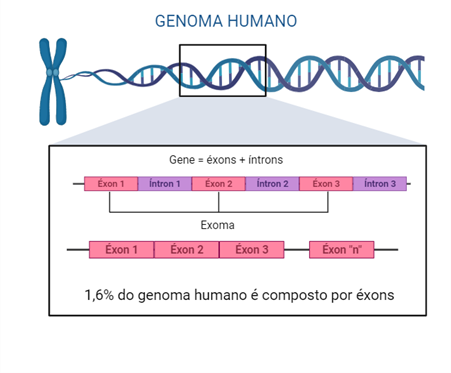
Existem várias causas possíveis para a epilepsia, sendo uma delas a origem genética. Em tais casos, a doença é resultante de uma mutação genética conhecida ou presumida, que tem as convulsões como um sintoma central.
É crucial esclarecer que “genético” não deve ser confundido com “hereditário”, uma vez que muitas das mutações genéticas associadas à epilepsia são do tipo “de novo” – ou seja, surgem no próprio indivíduo e não são herdadas de seus genitores. No entanto, esse indivíduo com a mutação pode transmitir o gene mutado para seus descendentes.
Diagnóstico da epilepsia
Baseado em avaliação clínica, o diagnóstico da epilepsia é feito com apoio de exames de imagem, como ressonância magnética e exames de eletroencefalografia, além da análise do histórico familiar. Em relação às epilepsias de origem genética, podem ser realizados exames específicos, como painéis de genes associados à epilepsia e sequenciamento do exoma completo.
Uma vez confirmado o diagnóstico, o tratamento deve ser iniciado rapidamente, podendo envolver tanto o uso de medicamentos anticonvulsivantes (com sucesso em até 70% dos casos) como terapias complementares, como dieta cetogênica, neurocirurgia e a implantação de um estimulador do nervo vago (VNS). Também existem outras opções que contemplam 30% das pessoas com epilepsia que não respondem ao tratamento com dois ou mais medicamentos combinados, necessitando de abordagens adicionais.
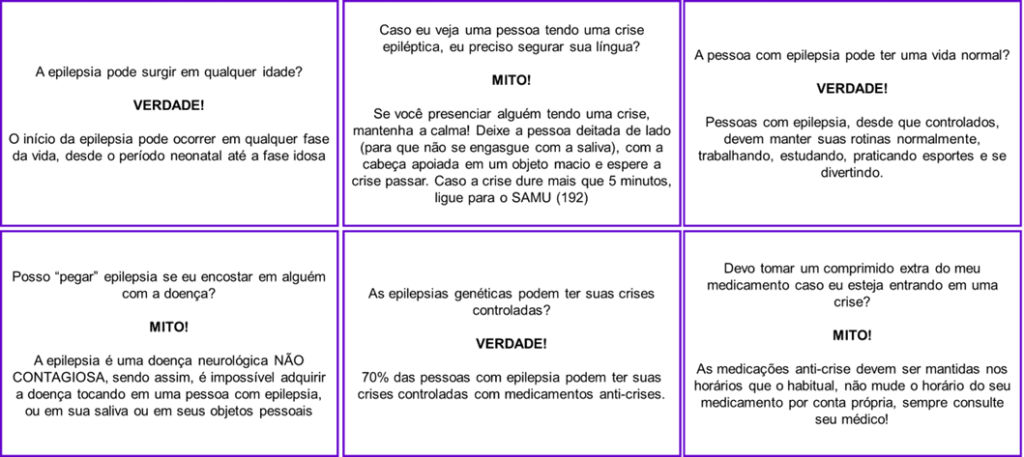
Além dos desafios médicos, as pessoas com epilepsia frequentemente enfrentam estigmas e preconceitos devido à falta de informação na sociedade. Portanto, é fundamental promover a conscientização, esclarecendo mitos e verdades relacionados à doença.